网友您好, 请在下方输入框内输入要搜索的题目:
题目内容
(请给出正确答案)
在0.1 mol/L的CH3COOH溶液中存在如下电离平衡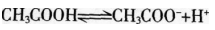 ,对该平衡下列叙述中,正确的是( )。
,对该平衡下列叙述中,正确的是( )。
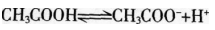 ,对该平衡下列叙述中,正确的是( )。
,对该平衡下列叙述中,正确的是( )。
A.加入水后,平衡向逆反应方向移动
B.加入0.1 mol/L的HCl溶液,溶液中c(H+)减小
C.加入少量NaOH固体,平衡向正反应方向移动
D.加入少量CH3COONa固体.平衡向正反应方向移动
B.加入0.1 mol/L的HCl溶液,溶液中c(H+)减小
C.加入少量NaOH固体,平衡向正反应方向移动
D.加入少量CH3COONa固体.平衡向正反应方向移动
参考答案
参考解析
解析:加水稀释,平衡向右移动,A项错误;加入HCl溶液,引入了H+,平衡向左移动,但c(H+)增大,B项错误;加入少量NaOH固体,中和了部分H+,平衡向右移动,C项正确;加入CH3COONa,。(CH3COOH-)增大。平衡向左移动。D项错误。
更多 “在0.1 mol/L的CH3COOH溶液中存在如下电离平衡,对该平衡下列叙述中,正确的是( )。 A.加入水后,平衡向逆反应方向移动 B.加入0.1 mol/L的HCl溶液,溶液中c(H+)减小 C.加入少量NaOH固体,平衡向正反应方向移动 D.加入少量CH3COONa固体.平衡向正反应方向移动” 相关考题
考题
已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是:A.该溶液的pH=4B.升高温度,溶液的pH增大C.此酸的电离平衡常数约为1×10-7D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
考题
25 ℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是A.均存在电离平衡和水解平衡B.存在的粒子种类相同C.c(OH-)前者大于后者D.分别加入NaOH固体,恢复到原温度,c(CO33-)均增大
考题
有关EDTA中的叙述中正确的是()。
A、EDTA在溶液中总共有7种型体存在B、EDTA是一个二元有机弱酸C、在水溶液中EDTA一共有5级电离平衡D、EDTA不溶于碱性溶液中E、EDTA易溶于酸性溶液中
考题
在0.1mol/L HAc溶液中,下列叙述中不正确的是哪一个?
A.加入少量NaOH溶液,HAc电离平衡向右移动
B.加H2O稀释后,HAc的电离度增加
C.加入浓HAc,由于增加反应物浓度,使HAc电离平衡向右移动,结果使HAc电离度增加
D.加入少量HCl,使HAc电离度减小
考题
下列比较中,正确的是()。
A.同温和同物质的量浓度时,HF比HCN易电离,则溶液pH:NaF>NaCN
B.物质的量浓度相等的H2S和NaHS混合溶液中:
C.
D.将①0.01mol·L-1的CH3COOH溶液;②0.01mol·L-1的盐酸;③pH=12的氨水;④pH=12的NaOH溶液稀释相同倍数后溶液的pH:③>④>②>①
考题
在一定条件下,电离达到平衡时,下列说法正确的是()。A、电离是一种静态平衡B、电离是一种动态平衡C、分子电离成离子的速度等于离子结合成分子的速度D、在同一瞬间内,溶液中的离子和分子的浓度保持不变
考题
在一定温度下,下列因素中使0.1mol·L-1HAc溶液中pH增加的因素是()A、加HCl溶液B、加0.1mol·L-1NaCl溶液C、加0.1mol·L-1NaAcD、加入0.1mol·L-1HAc溶液
考题
设弱酸HA的电离度为α,0.1mol/L溶液中的氢离子的浓度是:()A、αmol/LB、0.1αmol/LC、0.01αmol/LD、0.001αmol/LE、0.0001αmol/L
考题
下列溶液中,在检查重金属的硫代乙酰胺法中使用到的是()。A、0.1mol/L盐酸溶液B、0.1mol/L高氯酸溶液C、醋酸盐缓冲溶液(pH3.5)D、0.9mol/L氯化钠溶液E、0.1mol/L氢氧化钠溶液
考题
在0.1mol/LHAc溶液中,下列叙述中不正确的是哪一个?()A、加入少量NaOH溶液,HAc电离平衡向右移动B、加H2O稀释后,HAc的电离度增加C、加入浓HAc,由于增加反应物浓度,使HAc电离平衡向右移动,结果使HAc电离度增加D、加入少量HCl,使HAc电离度减小
考题
在0.1mol·L-1HAc溶液中,存在电离平衡,根据平衡移动原理,下列说法不正确的是()。A、加入浓HAc,由于增加反应物浓度,平衡向右移动,结果HAc解离度增大B、加入少量NaOH溶液,平衡向右移动C、加水稀释,解离度增加D、加入少量HCl,HAc的解离度减少
考题
单选题下列说法中,正确的是( )。A
某4.000mol/L H2SO4溶液,其H+浓度为4.000mol/LB
H3BO3的平衡常数Ka1=5.6×10-10,不能用标准碱溶液直接滴定C
在0.1mol/L HAc溶液中[H+]=0.1mol/LD
NaAc水溶液呈碱性E
NaAc水溶液呈酸性
考题
单选题设弱酸HA的电离度为α,0.1mol/L溶液中的氢离子的浓度是:()A
αmol/LB
0.1αmol/LC
0.01αmol/LD
0.001αmol/LE
0.0001αmol/L
考题
单选题在0.1mol·L-1HAc溶液中,存在电离平衡,根据平衡移动原理,下列说法不正确的是()。A
加入浓HAc,由于增加反应物浓度,平衡向右移动,结果HAc解离度增大B
加入少量NaOH溶液,平衡向右移动C
加水稀释,解离度增加D
加入少量HCl,HAc的解离度减少
考题
单选题向一定体积的0.1mol/L的醋酸溶液中加入等体积的蒸馏水后,则下列叙述正确的是()A
溶液的pH值变小B
醋酸的电离度增大C
溶液的导电能力减弱D
中和此溶液所需的0.1mol/LNaOH溶液的体积增加
考题
单选题在0.1mol/LHAc溶液中,下列叙述中不正确的是哪一个()?A
加入少量NaOH溶液,HAc电离平衡向右移动B
加H2O稀释后,HAc的电离度增加C
加入浓HAc,由于增加反应物浓度,使HAc电离平衡向右移动,结果使HAc电离度增加D
加入少量HCl,使HAc电离度减小
考题
单选题有关EDTA叙述正确的是()。A
EDTA在溶液中总共有7种型体存在B
EDTA是一个二元有机弱酸C
在水溶液中EDTA一共有5级电离平衡D
EDTA不溶于碱性溶液中E
EDTA易溶于酸性溶液中
热门标签
最新试卷
