网友您好, 请在下方输入框内输入要搜索的题目:
(1) X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为__________________________
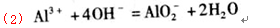
【解析】

A、NaOH
B、Na2CO3
C、Ca(OH)2
D、NaClO
下列离子方程式与所述事实相符且正确的是
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HclO+HCO-3
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl- Mn2++C
C.向NaAlO2溶液中通入过量CO2制Al(OH)3
↓HCO-3
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4;
(3)B中溶液发生反应的离子方程式是________ 。
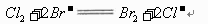
电解质溶液中的离子水化现象是
A、离子周围被水偶极子所包围
B、离子溶解于水溶液中
C、离子在溶液中与水的结合
D、电解质在水中保持离子状态
E、电解质溶液中离子与水化合
专题 水溶液中的离子平衡【2022年】1(2022海南卷)NaClO溶液具有添白能力,已知25时,。下列关于NaClO溶液说法正确的是A0.01mol/L溶液中,B长期露置在空气中,释放,漂白能力减弱C通入过量,反应的离子方程式为D25,的NaClO和HClO的混合溶液中,【答案】AD【解析】ANaClO溶液中ClO-会水解,故0.01mol/LNaClO溶液中c(ClO-)0.01mol/L,A正确;B漂白粉主要成分为Ca(ClO)2和CaCl2,长期露置在空气中容易和CO2发生反应而失效,其反应的化学方程式为:Ca(ClO)2+CO2+H2O=CaCO3+2HClO,HClO再分解:2HClO=2HCl+O2,不会释放Cl2,B错误;C将过量的SO2通入NaClO溶液中,SO2被氧化:SO2+ClO+H2O=Cl-+2H+,C错误;D25,pH=7.0的NaClO和HClO的混合溶液中,存在电荷守恒:c(ClO-)+c(OH-)=c(H+)+c(Na+),则c(ClO-)=c(Na+),又c(HClO)c(ClO-),所以c(HClO)c(ClO-)=c(Na+),D正确;答案选AD。2(2022浙江卷)时,苯酚的,下列说法正确的是A相同温度下,等的和溶液中,B将浓度均为的和溶液加热,两种溶液的均变大C时,溶液与溶液混合,测得,则此时溶液中D时,的溶液中加少量固体,水的电离程度变小【答案】C【解析】A醋酸的酸性大于苯酚,则醋酸根离子的水解程度较小,则相同温度下,等pH的C6H5ONa和CH3COONa溶液中c(C6H5O-)1.010-4.3,故用氢氧化钠滴定的过程中,醋酸也参加了反应,则离子方程式为:H+OH-=H2O和CH3COOH+OH-=CH3COO-+H2O,B错误;C滴定前盐酸和醋酸的浓度相同,故滴定过程中,根据物料守恒可知:,C正确;D向浓度均为的盐酸和醋酸的混合溶液中逐滴加入的溶液,当盐酸的体积为20ml时,溶液为氯化钠和醋酸的混合溶液,显酸性,需要再滴加适量的氢氧化钠,当加入的NaOH溶液的体积为30mL时,溶液为NaCl和等浓度的CH3COONa、CH3COOH,根据Ka=1.810-5Kh=可知,此时溶液仍然呈酸性,需继续滴加NaOH溶液,故有,D正确;故答案为:B。4(2022全国乙卷)常温下,一元酸的。在某体系中,与离子不能穿过隔膜,未电离的可自由穿过该膜(如图所示)。设溶液中,当达到平衡时,下列叙述正确的是A溶液中B溶液中的HA的电离度为C溶液和中的不相等D溶液和中的之比为【答案】B【解析】A常温下溶液I的pH=7.0,则溶液I中c(H+)=c(OH-)=110-7mol/L,c(H+)c(OH-)c(A-),A错误;B常温下溶液II的pH=1.0,溶液中c(H+)=0.1mol/L,Ka=1.010-3,c总(HA)=c(HA)+c(A-),则=1.010-3,解得=,B正确;C根据题意,未电离的HA可自由穿过隔膜,故溶液I和II中的c(HA)相等,C错误;D常温下溶液I的pH=7.0,溶液I中c(H+)=110-7mol/L,Ka=1.010-3,c总(HA)=c(HA)+c(A-),=1.010-3,溶液I中c总(HA)=(104+1)c(HA),溶液II的pH=1.0,溶液II中c(H+)=0.1mol/L,Ka=1.010-3,c总(HA)=c(HA)+c(A-),=1.010-3,溶液II中c总(HA)=1.01c(HA),未电离的HA可自由穿过隔膜,故溶液I和II中的c(HA)相等,溶液I和II中c总(HA)之比为(104+1)c(HA)1.01c(HA)=(104+1)1.01104,D错误;答案选B。5(2022湖南卷)室温时,用的标准溶液滴定浓度相等的、和混合溶液,通过电位滴定法获得与的关系曲线如图所示(忽略沉淀对离子的吸附作用。若溶液中离子浓度小于时,认为该离子沉淀完全。,)。下列说法正确的是Aa点:有白色沉淀生成B原溶液中的浓度为C当沉淀完全时,已经有部分沉淀Db点:【答案】C【解析】向含浓度相等的 Cl-、 Br-和 I-混合溶液中滴加硝酸银溶液,根据三种沉淀的溶度积常数,三种离子沉淀的先后顺序为I-、Br-、Cl-,根据滴定图示,当滴入4.50mL硝酸银溶液时,Cl-恰好沉淀完全,此时共消耗硝酸银的物质的量为4.50mL10-3L/mL0.1000mol/L=4.510-4mol,所以Cl-、 Br-和 I-均为1.510-4mol。AI-先沉淀,AgI是黄色的,所以a点有黄色沉淀AgI生成,故A错误;B原溶液中I-的物质的量为1.510-4mol,则I-的浓度为=0.0100molL-1,故B错误;C当Br-沉淀完全时(Br-浓度为1.010-5mol/L),溶液中的c(Ag+)=5.410-8mol/L,若Cl-已经开始沉淀,则此时溶液中的c(Cl-)=3.310-3mol/L,原溶液中的c(Cl-)= c(I-)=0.0100molL-1,则已经有部分Cl-沉淀,故C正确;Db点加入了过量的硝酸银溶液,Ag+浓度最大,则b点各离子浓度为:,故D错误;故选C。6(2022山东卷)工业上以为原料生产,对其工艺条件进行研究。现有含的、溶液,含的、溶液。在一定pH范围内,四种溶液中随pH的变化关系如图所示。下列说法错误的是A反应的平衡常数BC曲线代表含的溶液的变化曲线D对含且和初始浓度均为的混合溶液,时才发生沉淀转化【答案】D【解析】硫酸是强酸,溶液pH变化,溶液中硫酸根离子浓度几乎不变,则含硫酸锶固体的硫酸钠溶液中锶离子的浓度几乎不变,pH相同时,溶液中硫酸根离子越大,锶离子浓度越小,所以曲线代表含硫酸锶固体的0.1mol/L硫酸钠溶液的变化曲线,曲线代表含硫酸锶固体的1mol/L硫酸钠溶液的变化曲线;碳酸是弱酸,溶液pH减小,溶液中碳酸根离子离子浓度越小,锶离子浓度越大,pH相同时,1mol/L碳酸钠溶液中碳酸根离子浓度大于0.1mol/L碳酸钠溶液,则曲线表示含碳酸锶固体的0.1mol/L碳酸钠溶液的变化曲线,曲线表示含碳酸锶固体的1mol/L碳酸钠溶液的变化曲线。A反应SrSO4(s)+COSrCO3(s)+SO的平衡常数K=,故A正确;B由分析可知,曲线代表含硫酸锶固体的0.1mol/L硫酸钠溶液的变化曲线,则硫酸锶的溶度积Ksp(SrSO4)=105.50.1=106.5,温度不变,溶度积不变,则溶液pH为7.7时,锶离子的浓度为=106.5,则a为6.5;C由分析可知,曲线表示含碳酸锶固体的1mol/L碳酸钠溶液的变化曲线,故C正确;D由分析可知,硫酸是强酸,溶液pH变化,溶液中硫酸根离子浓度几乎不变,则含硫酸锶固体的硫酸钠溶液中锶离子的浓度几乎不变,所以硫酸锶的生成与溶液pH无关,故D错误;故选D。7(2022海南卷)某元素M的氢氧化物在水中的溶解反应为:、,25,-lgc与pH的关系如图所示,c为或浓度的值,下列说法错误的是A曲线代表与pH的关系B的约为C向的溶液中加入NaOH溶液至pH=9.0,体系中元素M主要以存在pH=9.0,体系中元素M主要以存在D向的溶液中加入等体积0.4mol/L的HCl后,体系中元素M主要以存在【答案】BD【解析】由题干信息,M(OH)2(s)M2+(aq)+2OH-(aq),M(OH)2(s)+2OH-(aq)M(OH)(aq),随着pH增大,c(OH-)增大,则c(M2+)减小,cM(OH)增大,即-lg c(M2+)增大,-lg cM(OH)减小,因此曲线代表-lg c(M2+)与pH的关系,曲线代表-lg cM(OH)与pH的关系,据此分析解答。A由分析可知,曲线代表-lg c(M2+)与pH的关系,A正确;B由图象,pH=7.0时,-lg c(M2+)=3.0,则M(OH)2的Ksp=c(M2+)c2(OH-)=110-17,B错误;C向c(M2+)=0.1mol/L的溶液中加入NaOH溶液至pH=9.0,根据图像,pH=9.0时,c(M2+)、cM(OH)均极小,则体系中元素M主要以M(OH)2(s)存在,C正确;DcM(OH)=0.1mol/L的溶液中,由于溶解平衡是少量的,因此加入等体积的0.4mol/L的HCl后,体系中元素M仍主要以M(OH)存在,D错误;答案选BD。【2021年】1(2021全国乙)HA是一元弱酸,难溶盐MA的饱和溶液中随c(H+)而变化,不发生水解。实验发现,时为线性关系,如下图中实线所示。下列叙述错误的是A溶液时,BMA的溶度积度积C溶液时,DHA的电离常数【答案】C【分析】本题考查水溶液中离子浓度的关系,在解题过程中要注意电荷守恒和物料守恒的应用,具体见详解。【详解】A由图可知pH=4,即c(H+)=1010-5mol/L时,c2(M+)=7.510-8mol2/L2,c(M+)=mol/L3.010-4mol/L,A正确;B由图可知,c(H+)=0时,可看作溶液中有较大浓度的OH-,此时A-的水解极大地被抑制,溶液中c(M+)=c(A-),则,B正确;C设调pH所用的酸为HnX,则结合电荷守恒可知,题给等式右边缺阴离子部分nc(Xn-),C错误;D当时,由物料守恒知,则,则,对应图得此时溶液中,D正确;故选C。2(2021浙江)取两份 的溶液,一份滴加的盐酸,另一份滴加溶液,溶液的pH随加入酸(或碱)体积的变化如图。下列说法不正确的是A由a点可知:溶液中的水解程度大于电离程度B过程中:逐渐减小C过程中:D令c点的,e点的,则【答案】C【分析】向溶液中滴加盐酸,溶液酸性增强,溶液pH将逐渐减小,向溶液中滴加NaOH溶液,溶液碱性增强,溶液pH将逐渐增大,因此abc曲线为向溶液中滴加NaOH溶液,ade曲线为向溶液中滴加盐酸。【详解】Aa点溶质为,此时溶液呈碱性,在溶液中电离使溶液呈酸性,在溶液中水解使溶液呈碱性,由此可知,溶液中的水解程度大于电离程度,故A正确;B由电荷守恒可知
A.NaClO溶液
B.浓盐酸
C.KMnO4溶液
D.Br2/CCl4溶液
A.能与碱作用生成水
B.其水溶液能使石蕊试纸变红
C.其水溶液有氢离子和酸根离子
D.在水溶液中电离产生的阳离子只有H+
A. NaCl B. Na2CrO4 C. NaCrO2 D. NaClO
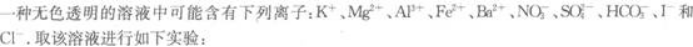
(1)将溶液滴在pH试纸上,试纸显红色.
(2)将少许溶液浓缩后加入铜片和硫酸,有无色气体析出.此气体遇空气则立即变为红棕色.
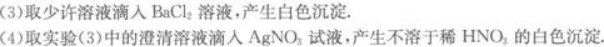
(5)另取少许溶液滴入NaOH溶液,有白色沉淀生成.当NaOH过量时,又有部分白色沉淀溶解.
根据以上现象判断,原溶液中肯定不存在的离子是____________;肯定存在的离子是____________;不能作出判断的离子是____________.写出各步反应的离子方程式____________________________________。
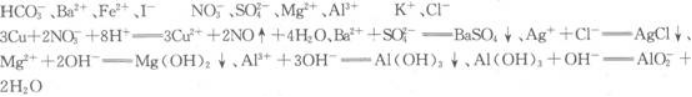
更多 “2022年高考近5年化学试题汇编《水溶液中的离子平衡》” 相关考题
- 在XSL样式表中,使用()元素可以访问所有符合条件的子节点。
- 填空题为了进一步推动全民健身并弘扬少数民族文化,第十届少数民族传统体育运动会的竞赛项目中新增加了()。这一项目把民族舞蹈与健身操动作合二为一,不仅继承了民族舞蹈的优秀元素,开拓了民族舞蹈的现代性,更让民族文化和体育健身融为一体。
- XML文档的架构验证可以使用哪些方法?()A、文档类型定义(DTD)B、XML数据简化(XDR)C、XML架构定义(XSD)D、XML词汇表(XST)
- 有函数illI m(float x){floal 2;z=。;rehJrn(z);l用n=m(3 5);调用.则返回值是() A、3B、3.5C、4D、实型值
- 如果有一个标记“<name>”,想让标记中的内容显示为文本块,字体为楷体,大小是20磅,颜色为蓝色,背景是黄色。在CSS中应设置哪些属性,属性值如何设置?
- 多选题在重复保险的情况下,当发生保险事故时,保险标的所遭受的损失由各保险人分摊,分摊的方式有()。A比例责任分摊方式B限额责任分摊方式C等额责任分摊方式D顺序责任分摊方式
- 单选题按照我国《保险法》的规定,保险人与被保险人或受益人达成赔偿协议或给付保险金额协议的情况下,应在达成协议后()内履行赔偿或给付义务。A 30日B 20日C 15日D 10日
- 有宏定义#define M(x)x*x*2;则a=M(2+3)的值() A、2B、3C、11D、14
- 单选题险人在保险标的发生风险事故后,对被保险人或受益人提出的索赔要求进行处理的行为是指()A 保险索赔B 保险理赔C 保险审请D 保险查勘
- 名词解释题人身保险