网友您好, 请在下方输入框内输入要搜索的题目:
下列物质的鉴别方法正确的是
A.用澄清石灰水鉴别氢气和一氧化碳 B.用无色酚酞鉴别碳酸钠溶液和氢氧化钠溶液
C.用食盐水鉴别硬水和软水 D. 用水鉴别硝酸铵固体和氢氧化钠固体
下列两种物质的溶液混合后,能发生反应,且溶液的总质量不会发改变的是( )
A.氢氧化钠溶液和稀盐酸 B.碳酸钠溶液和稀盐酸
C.氯化钠溶液和稀硫酸 D.碳酸钠溶液和氯化钙溶液
下列各组物质充分反应后,溶液质量比反应前的溶液质量减小的是【】
A.铁片浸入稀硫酸中
B.铁片浸入硫酸铜溶液中
C.氧化铁粉末加入稀盐酸中
D.碳酸氢钠粉末加入稀盐酸中
实验室制取氯化氢的方法是( )。
A.氯化钠溶液与浓硫酸加热反应
B.氯化钠溶液与稀硫酸加热反应
C.氯化钠晶体与浓硫酸加热反应
D.氯化钠晶体与稀硫酸加热反应
下列各组物质混合后,溶液质量不发生改变的是( )。
A.KOH溶液和盐酸
B.BaCl2和稀H2SO4
C.Na2CO3溶液和盐酸
D.Fe和Cu(NO3)2溶液
摘要:第九单元《金属》单元测试题一、单选题(每小题只有一个正确答案)1.下列各组物质中,能相互反应且反应后溶液总质量增加的是()A.铁和硫酸铜溶液B.氧化铁固体和稀硫酸C.盐酸和澄清石灰水D.氯化钠溶液和硝酸银溶液2.如图为小柯做的创新实验:将铜丝绕在电烙铁上,电烙铁用支架固定在密闭的硬质玻璃管中,玻璃管置于灵敏电子台秤上。接通电路,电烙铁开始工作,可以观察到铜丝表面逐渐变黒,电子台秤读数保持不变。下列说法正确的是()A.该反应的化学方程式为Cu+O2=CuOB.加热过程中,玻璃管内空气的质量保持不变C.加热过程中,铜丝的质量保持不变D.硬质玻璃管内物质在反应前后总质量保持不变3.下列化学方程式书写及其反应类型判断均正确的是()A.木炭还原氧化铜:C+CuOB.甲烷燃烧:CH4+2O2C.工业炼铁:Fe2O3+3COCu+CO2↑置换反应2H2O+CO2化合反应2Fe+3CO2置换反应D.碱式碳酸铜受热:Cu2(OH)2CO32CuO+CO2↑+H2O分解反应4.下图所示的四个图像,能正确反映对应变化关系的是()A.水的电解B.将一定质量的硫酸铜溶液倒入盛有铁钉的烧杯中C.向少量的H2O2溶液中加入MnO2固体D.加热一定量KMnO4固体5.下列物质的变化中,只有加酸才能一步实现的是()A.CaCO3→CO2B.Zn→ZnSO4C.CuO→CuCl26.下列说法正确的是()第1页共16页D.KOH→KCl A.在化学反应中只有燃烧反应才能放出热量B.合金的硬度一般比组成它们的纯金属更高C.高炉炼铁的产品是纯铁D.铝制品比铁制品耐腐蚀,说明铝的活动性不如铁7.硬
根据复分解反应发生的条件,并利用书后附录I所提供的信息,判断下列物质间能否发生复分解反应。如能发生反应,写出反应的化学方程式。
(1)碳酸钠溶液和氯化钙溶液
(2)氢氧化钾溶液和盐酸
(3)氢氧化钠溶液和氯化钾溶液
(4)碳酸钾溶液和盐酸
(5)硫酸铜溶液和氯化钡溶液
将铁片放入下列溶液中,充分反应后溶液质量减小的是( )
A.三氯化铁
B.稀硫酸
C.硫酸铜
D.浓盐酸
B.澄清的石灰水
C.硫酸亚铁溶液
D.硝酸银溶液
B.物质的量浓度相同
C.溶质的质量分数相同
D.pH相同

由此可知,若消耗NaOH溶液的量相等,则盐酸、醋酸溶液中所含溶质的物质的量一定相等,但质量一定不等,即n(HCl)=n(CH3COOH),m(HCl)≠m(CH3COOH).

质的量浓度相等.故B选项正确.
因不知溶液的总质量,所以溶质的质量分数一般不同,即C选项错误.
(2)其次,应知道盐酸是强酸,醋酸是弱酸,它们的电离程度不同.
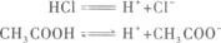
当HCl、CH3COOH的物质的量相同时,溶液中H+的物质的量一定不同,即H+的物质的量浓度一定不同.所以A选项错误.
(3)根据pH=-lg c(H+)可知,H+浓度不同,溶液的pH也一定不同,即溶液的酸性强弱不同.所以D选项也错误.
B.过量铁粉与CuCl2溶液
C.过量氯水与FeCl2溶液
D.过量铁粉与FeCl3溶液

Fe3+.所以只要有Fe3+生成,加入KSCN溶液后就能显示血红色.这与氯水过量与否关系不大,只是若氯水过量,可将FeCl2全部变成FeCl3.而与KSCN反应显示血红色,不必全部转化成FeCl3.所以,C选项为正确选项.
更多 “鲁教版初中化学九年级下册第九单元《金属》单元测试题(解析版)” 相关考题
- 计算机病毒攻击战是指将( )植入敌方计算机系统,删除其数据,瘫痪其系统。A.网络病毒B.基因病毒C.计算机病毒D.生物病毒
- “单选(5分)“我能,无限可能”和“to be NO.1”体现的是哪种需要( )A. 自我实现的需要B. 归属和爱的需要C. 生理需要D. 安全需要
- 金融行业的所有资产都是金融资产。
- 每一笔贷款只能展期一次.
- 期望理论可以用( )来加以表述。A。结果=效价×期望 B。动机=效价×工具 C.动机=效价×期望×工具 D.结果=效价×期望×工具
- 1980年中国的GDP是美国的____,到2020年中国的GDP是美国的____?
- 形位公差带形状是距离为公差值t的两平行平面内区域的有()A.径向全跳动B.端面全跳动C.平面度D.直线度
- ( )是精神分析学派的开创者。A.荣格B.弗洛伊德C.阿德勒D.埃里克森
- 注明“现金”字样的银行本票不得背书转让。
- 中国武装力量是由人民解放军、武装警察部队和()组成。A. 基干B. 普通民兵C. 民兵D. 后备部队
- 精编国家开放大学电大专科《民事诉讼法学》2024期末试题及答案(试卷号:2099)_
- 精编国家开放大学电大专科《民事诉讼法学》2029期末试题及答案(试卷号:2099)_
- 二年级语文下册第五单元试题-
- 公共营养师考试美容营养备考指导:初秋必吃的7种美-
- 公共营养师考试饮食营养:常吃黑米抗衰老-
- 营养师小知识:考试题库最新考试题库(完整版)-
- 全国人力资源和社会保障法制知识网络竞赛题库带答案解析8.12-
- 精编国家开放大学电大专科《物业设备设施管理》2021期末试题及答案(试卷号:222)_
- 精编国家开放大学电大专科《物业设备设施管理》2024期末试题及答案(试卷号:2227)_
- 精编国家开放大学电大专科《物业设备设施管理》2023期末试题及答案(试卷号:2227)_