网友您好, 请在下方输入框内输入要搜索的题目:
B.物质的量浓度相同
C.溶质的质量分数相同
D.pH相同

由此可知,若消耗NaOH溶液的量相等,则盐酸、醋酸溶液中所含溶质的物质的量一定相等,但质量一定不等,即n(HCl)=n(CH3COOH),m(HCl)≠m(CH3COOH).

质的量浓度相等.故B选项正确.
因不知溶液的总质量,所以溶质的质量分数一般不同,即C选项错误.
(2)其次,应知道盐酸是强酸,醋酸是弱酸,它们的电离程度不同.
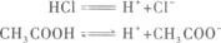
当HCl、CH3COOH的物质的量相同时,溶液中H+的物质的量一定不同,即H+的物质的量浓度一定不同.所以A选项错误.
(3)根据pH=-lg c(H+)可知,H+浓度不同,溶液的pH也一定不同,即溶液的酸性强弱不同.所以D选项也错误.
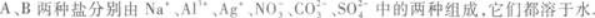
(1)往两种溶液中分别加入盐酸,A溶液不反应,B溶液产生无色无味气体.
(2)往两种溶液中分别加入过量NaOH溶液,A溶液先产生白色沉淀,然后沉淀消失,B溶液与NaOH不反应.
(3)往两种盐溶液中分别加入BaCl2溶液,都产生白色沉淀.再分别加入稀HNO3,A中沉淀不消失,B中沉淀消失.由此可知,A的化学式为____________,B的化学式为____________.
(1)加入盐酸,B溶液产生无色无味气体.在给出的6种离子中只

即B一定是碳酸盐.
(2)加入过量NaOH溶液,A溶液先产生白色沉淀,然后沉淀消失,显然这是Al3+的特征反应.其反应方程式为

即A中一定含有Al3+,是铝盐.
(3)向A、B溶液中分别加入BaCl2溶液,都有白色沉淀生成.再分别加入稀HNO3,A中沉淀

一金属M与干燥的Cl2共热得一无色液体A,A与过量金属作用则转变为固体B.A的HCl水溶液通入H2S,则得黄色沉淀C,C可溶于(NH4)2S溶液生成化合物D,D的盐酸水溶液加入NaOH则生成沉淀,当NaOH过量,则沉淀溶解得溶液E,于E中加入铋(Ⅲ)盐,则有黑色固体F析出,试确定M和A→F各是什么物质
正确答案:MSn,A—SnCl4,B—SnCl2,C—SnS2,
D(NH4)2SnS3,E—Na2〔Sn(OH)4〕
F----Bi
有一种铝盐是白色晶体,溶于水,溶液混浊,滴加少量盐酸混浊消失,在清液中加入硝酸银溶液生成白色沉淀A,此沉淀不溶于稀硝酸;过滤后在滤液中滴加氢氧化钠溶液,生成白色沉淀,继续滴加过量NaOH,白色沉淀消失形成澄清溶液B,由此推断白色晶体是(),沉淀A是()
正确答案:AlCl3;AgCl
在H3PO4溶液中加入一定量NaOH溶液后,溶液的pH值=14.00,下列物种中浓度最大的是()。
- A、H3PO4
- B、H2PO4-
- C、HPO42-
- D、PO43-
正确答案:D
葫芦岛一高中课外拓展训练 高一年级化学学科铝的重要化合物一、选择题(每小题4分,共48分)1(双选题)将一定量的镁铝合金放入一定量的盐酸中,合金恰好全部溶解,向所得溶液中滴加一定浓度的NaOH溶液,加入的NaOH溶液的体积(V)与沉淀质量(m)的关系如图所示。下面说法正确的是( )AA点的沉淀是Mg(OH)2、Al(OH)3BB点的沉淀是Mg(OH)2、Al(OH)3CA点的沉淀是Al(OH)3DB点的沉淀是Mg(OH)22下列各组离子中,在强碱性溶液中能共存,且在加入盐酸过程中会产生气体和沉淀的是()ANa、NO、AlO、SOBNa、Al3、NO、SOCK、Cl、AlO、CO DNa、Mg2、Cl、HCO3甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则淀淀消失;若将丁溶液滴入甲溶液中,无明显现象发生,据此可推断丙物质是()AAl2(SO4)3 BNaOH CBaCl2 DFeSO44将100 mL 3 molL1的NaOH溶液与100 mL 1 molL1的AlCl3溶液,按下列两种方法相混合:将NaOH逐滴加入AlCl3中,边加边振荡将AlCl3逐滴加入NaOH中,边加边振荡。对上述实验所得出的结论正确的是()A现象相同,沉淀量相同 B现象相同,沉淀量不相同C现象不相同,沉淀量相同 D现象不相同,沉淀不相同5下图表示AlCl3溶液与NaOH溶液的相互滴加,则下列说法中错误的是()A线表示Al3物质的量的变化Bx表示AlCl3的物质的量C线表示Al(OH)3物质的量的变化D线表示AlO物质的量的变化6在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀 的质量与加入的NaOH溶液体积的关系如下图所示,由此确定,原溶液中含有的阳离子是()AMg2、Al3、Fe2 BH、Mg2、Al3CH、Ba2、Al3 D只有Mg2、Al37有100 mL MgCl2和AlCl3的混合液,其中c(Mg2)0.2 mol/L, c(Cl)1.3 mol/L,要使Mg2完全转化为Mg(OH)2且与Al3恰好分离,至少需要2 mol/L NaOH溶液的体积为()A80 mL B100 mL C120 mL D110 mL8下列各组物质,不能按bca(“”表示反应一步完成)所示关系转化的是()选项abcAAl2O3NaAlO2Al(OH)3BAlCl3Al(OH)3NaAlO2CAlAl(OH)3Al2O3DMgCl2Mg(OH)2MgO9等体积的AlCl3和NaOH两种溶液混合后,沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则AlCl3和NaOH两种溶液物质的量浓度之比是()1:32:31:42:7AB C D10使一镁铝合金粉末在过量稀H2SO4中溶解,在所得溶液中加入 NaOH溶液,生成沉淀的质量W和加入NaOH溶液的体积V的关系如下图所示,则该合金中镁和铝的质量之比为()A2:3 B1:1 C4:3 D8;911在V L Al2(SO4)3溶液中加入过量氨水,过滤得沉淀,然后在高温中灼烧沉淀最后得到白色固体m g,溶液中SO的物质的量浓度是()A. molL1 B. molL1 C. molL1 D. molL112有镁铝混合粉末10.2 g,将它溶于500 mL 4 molL1的盐酸中,若要使沉淀的质量最大,则需加入2 molL1的氢氧化钠溶液的体积是()A1 000 mL B500 mL C100 mL D1 500 mL二、非选择题(共52分)13(10分)A、B、C、D、E五种物质均含有某种常见金属元素,它们的转化关系如图所示,某中B为白色难溶固体,E则易溶于水。(1) 写出化学式:A_、B_、C_、D_。(2) 写出下列反应的化学方程式:BC_。BD_。(3) 写出下列反应的离子方程式:AD_。CD_。14(10分)某校化学兴趣小组用如图所示过程除去AlCl3中含有Mg2、K杂质离子并尽可能减少AlCl3的损失。请回答下列问题:(1) 写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:_。(2) 氢氧化钠溶液能否用氨水代替,为什么?_。(3) 溶液a中存在的离子有_;在溶液a中加入盐酸时需控制盐酸的量,为什么?_。为此,改进方法是_。15(10分)现用0.1 mol/L的AlCl3溶液和0.1 mol/L的氢氧化钠溶液,进行下面的实验。在试管中盛有上述AlCl3溶液10 mL,向其中逐滴滴入上述的NaOH溶液。(1) 加入10 mL NaOH溶液时的现象是_,加入30 mL NaOH溶液时的现象是_,加入35 mL NaOH溶液时的现象是_。(2) 生成沉淀质量最多时,需NaOH溶液_mL。16(11分)把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的浊液中逐滴加入1 molL1 HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如下图所示,试回答:(1) A点的沉淀物的化学式为_;B点的沉淀物的化学式为_。(2) 原混合物中MgCl2的质量是_g,AlCl3的质量是_g,NaOH的质量是_g。(3) Q点HCl溶液加入量是_mL。17(11分)Al(OH)3是治疗胃酸过多的药物胃舒平的主要成分。某课外兴趣小组用铝、稀硫酸、烧碱为原料,制备一定量的Al(OH)3。他们分别设计了两种实验方案:方案一:AlAl2(SO4)3Al(OH)3方案二:AlNaAlO2Al(OH)3(1) 从节约药品的角度思考,你认为哪一种方案好?_,方案一和方案二共同存在的问题是_(2) 请用相同的原料设计一个更为节约药品的方案,并写出有关反应的化学方程式。参考答案1. AD 2. C 3. D 4. C 5. B 6. B 7. A 8. C 9. C 10. D 11. D 12. A13.答案:(1)Al(OH)3Al2O3AlAlCl3(2)2Al2O3熔融电解,4Al3O2Al2O36HCl=2AlCl33H2O(3)Al(OH)33H=Al33H2O2Al6H=2Al33H214.答案:(1)Mg22OH=Mg(OH)2Al33OH=Al(
在H3PO4溶液中加入一定量NaOH溶液后,溶液的pH值=14.00,下列物种中浓度最大的是()。
- A、H3PO4
- B、H2PO4-
- C、HPO42-
- D、PO43-
正确答案:D
用C(NaOH) = 0.1000mol/L的NaOH溶液20.00ml滴定相同体积、相同浓度的HCl溶液,当滴加的NaOH溶液为19. 98ml时,体系的pH = 3.30。
正确答案:错误
在水溶液中用酸碱滴定法测定NaAc的含量:加入一定量的标准HCl溶液,然后再用NaOH标准溶液返滴定过量的HCl。
正确答案:错误
在无色溶液A中加入NaOH产生褐色沉淀B,若加入NaH2PO4产生黄色沉淀C.将B过滤,部分滤液放入试管中加入适量浓H2SO4,再加入适量FeSo4溶液产生棕色环D,将B溶于HNO3,再滴加NaCl溶液过程中先产生白色沉淀E,而后E沉淀消失变成无色溶液F,将E放入Na2S2O3溶液中则E溶解为无色溶液G.判断A,B,C,D,E,F,G各为何物
正确答案:A.AgNO3
B.Ag2O
C.Ag3PO4
D.Fe(NO)2+
E.AgCl
F.AgCl2-
G.[Ag(S2O3)2]3-
盐析是利用不同物质在高浓度的盐溶液中溶解度的差异,向溶液中加入一定量的中性盐,使原溶解的物质沉淀析出的分离技术。
正确答案:正确
更多 “高中化学必修一:322铝的重要化合物 课外拓展训练 word版含答案” 相关考题
- Response对象的()方法可以将缓冲区中的页面内容立即输出到客户端。A. WriteB. EndC. ClearD. Flush
- 本行为付款行,对方行为收款行的网内往来汇划业务是发出贷方报单业务。
- 银行账务组织包括哪些内容?各项内容之间的关系如何?
- 把自己自身的感觉强加于对方是哪种自我防御机制( )。A.合理化B.升华作用C.投射D.转移
- “单选(5分)“我能,无限可能”和“to be NO.1”体现的是哪种需要( )A. 自我实现的需要B. 归属和爱的需要C. 生理需要D. 安全需要
- 每一笔贷款只能展期一次.
- 中长期贷款展期不得超过原贷款期限的一半,最长不得超过5年.
- ( 难度:中等)关于参数传递说法正确的()A.A:基本数据类型参数传递的是值,引用数据类型参数传递的是引用B.B:不管是基本数据类型还是引用数据类型都是值传递C.C:基本数据类型参数传递的是数据值,引用数据类型参数传递的是对象D.D:基本数据类型参数是值传递,引用数据类型传递是引用传递
- ( 难度:中等)hive基本表类型有哪些A.内部表B.外部表C.分区表D.桶表
- 出票人在支票上的签章,必须与预留银行印鉴相符。