网友您好, 请在下方输入框内输入要搜索的题目:
题目内容
(请给出正确答案)
反应Sn2++ 2Fe3+ =Sn4++2Fe2+能自发进行,将其设计为原电池,电池符号为:
A. (-)C Fe2+(C1)、Fe3+(C2) Sn4+(C3)、Sn2+(C4) Pt(+)
B. (-)Pt Sn4+(C1)、Sn2+(C2) Fe2+(C3)、Fe3+(C4) C(+)
C. (+)C Fe2+(C1)、Fe3+(C2) Sn4+(C3)、Sn2+(C4) Sn(-)
D. (-)Pt Sn4+(C1)、Sn2+(C2) Fe2+(C3)、Fe3+(C4) Fe(+)
B. (-)Pt Sn4+(C1)、Sn2+(C2) Fe2+(C3)、Fe3+(C4) C(+)
C. (+)C Fe2+(C1)、Fe3+(C2) Sn4+(C3)、Sn2+(C4) Sn(-)
D. (-)Pt Sn4+(C1)、Sn2+(C2) Fe2+(C3)、Fe3+(C4) Fe(+)
参考答案
参考解析
解析:提示:由反应方程式可得出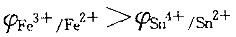 ;电极电势高的是正极,低的是负极;原电池的负极写在左边,正极写在右边;同种金属不同价态的离子必须用惰性电极作导体。
;电极电势高的是正极,低的是负极;原电池的负极写在左边,正极写在右边;同种金属不同价态的离子必须用惰性电极作导体。
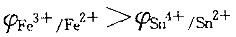 ;电极电势高的是正极,低的是负极;原电池的负极写在左边,正极写在右边;同种金属不同价态的离子必须用惰性电极作导体。
;电极电势高的是正极,低的是负极;原电池的负极写在左边,正极写在右边;同种金属不同价态的离子必须用惰性电极作导体。
更多 “反应Sn2++ 2Fe3+ =Sn4++2Fe2+能自发进行,将其设计为原电池,电池符号为: A. (-)C Fe2+(C1)、Fe3+(C2) Sn4+(C3)、Sn2+(C4) Pt(+) B. (-)Pt Sn4+(C1)、Sn2+(C2) Fe2+(C3)、Fe3+(C4) C(+) C. (+)C Fe2+(C1)、Fe3+(C2) Sn4+(C3)、Sn2+(C4) Sn(-) D. (-)Pt Sn4+(C1)、Sn2+(C2) Fe2+(C3)、Fe3+(C4) Fe(+) ” 相关考题
考题
在电化学分析方法中,原电池是A、能在外加电能下将化学能转换为电能的化学电池B、能自发地将化学能转换为电能的化学电池C、能在外加电能下将电能转换为化学能的化学电池D、能自发地将电能转换为化学能的化学电池E、能将化学能和电能相互转换的化学电池
考题
根据反应Sn2++ 2Fe3+ →Sn4++2Fe2+构成的原电池,测得EΘ=0. 616V,已知
A. 1. 386V
B. 0. 154V
C.-0.154V
D. -1. 386V
考题
根据反应Sn2++ 2Fe3+ →Sn4++2Fe2+构成的原电池,测得EΘ=0. 616V,已知
A. 1. 386V B. 0. 154V C.-0.154V D. -1. 386V
考题
下列有关原电池的叙述中,正确的是( )。A: 原电池是将化学能转化为电能的装置
B: 用导线连接的两种不同金属同时插入液体中.能形成原电池
C: 在原电池中,电子流出的一极是负极,发生氧化反应
D: 原电池放电时,电解质溶液中的阳离子向正极移动
考题
下列关于原电池的叙述中正确的是A.原电池能将化学能转变为电能 ? ? ? ?
B.原电池负极发生的是还原反应 ? ? ? ? ?
C.原电池在工作时,正极不断产生电子并经外电路流向负极 ? ? ?
D.原电池的电极只能由两种不同的金属构成
考题
关于原电池下列表述不正确的是()A、由两种不同材料的电极组成B、碳电极不参与任何化学反应C、原电池在由化学能转换为电能时,负极被逐渐腐蚀而无法恢复D、原电池在由化学能转换为电能时,负极被逐渐腐蚀但能够恢复
考题
电化学分析法中的原电池指的是().A、能将化学能转变为电能的化学电池B、能将电能转变为化学能的化学电池C、能自发地将化学能转变为电能的化学电池D、能自发地的氧化还原的反应的化学电池E、靠消耗外加电源电能才能诱发电能转化为化学能的化学电池
考题
下列说法中错误的是()。A、原电池正极发生还原反应,负极发生氧化反应B、原电池中氧化剂在原电池的正极C、原电池的电池反应就是作为氧化剂的物质同作为还原剂的物质起反应D、原电池中,电极电位较低的电对组成电池的正极
考题
现有酸性KMnO4和Pb(NO2)2溶液各一杯,选金属铂(Pt)棒插入KMnO4溶液中,金属铅(Pb)棒插入Pb(NO2)2溶液中,已知参与反应物质浓度均为1mol.L-1,φΘ(Pb2+/Pb)=-0.126V,φΘ(MnO4-/Mn2+)=+1.491V. (1)试判断该原电池反应自发进行的方向。 (2)完成并配平上述原电池反应方程式,以及两电极反应式。 (3)用电池符号表示该原电池,并计算其标准电动势和平衡常数。
考题
单选题电化学分析法中的原电池指的是().A
能将化学能转变为电能的化学电池B
能将电能转变为化学能的化学电池C
能自发地将化学能转变为电能的化学电池D
能自发地的氧化还原的反应的化学电池E
靠消耗外加电源电能才能诱发电能转化为化学能的化学电池
考题
填空题借助于氧化还原反应将化学能直接转变为()的装置叫做原电池。
热门标签
最新试卷
