网友您好, 请在下方输入框内输入要搜索的题目:
题目内容
(请给出正确答案)
称取试样1.000g溶解,将其中的磷沉淀为磷钼酸铵,用20.00mL,0.1000mol·L-1NaOH溶解沉淀,过量的NaOH用0.2000mol·L-1HNO3,7.50mL滴至酚酞终点,计算试样中w(P)、w(P2O5)。 已知: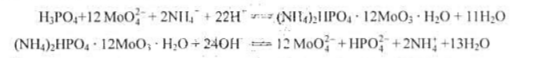
参考答案
更多 “ 称取试样1.000g溶解,将其中的磷沉淀为磷钼酸铵,用20.00mL,0.1000mol·L-1NaOH溶解沉淀,过量的NaOH用0.2000mol·L-1HNO3,7.50mL滴至酚酞终点,计算试样中w(P)、w(P2O5)。 已知: ” 相关考题
考题
称取Pb3O40.1000g,以HCl溶液溶解,加热下,用过量K2Cr2O7将Pb2+沉淀完全,反应为2Pb2++Cr2O72-+H2O ↔2PbCrO4↓+2H+,冷却后过滤洗涤,将PbCrO4沉淀以HCl溶液溶解,加入过量KI,用0.1000mol·L-1Na2S2O3溶液滴定,终点时用去12.00ml,求试样中Pb3O4的质量分数。 [M(Pb3O4)=685.6g·mol-1]
考题
植物试样中磷的定量测定方法是先处理试样,使磷转化成为PO43-,然后将其沉淀为磷钼酸铵(NH4)3PO4·12MoO3,并称其质量。如果由0.2711g试样中得到1.1682g沉淀,计算试样中P和P2O5的质量分数()
A、5.111%,12.30%B、9.111%,6.30%C、7.111%,16.30%D、6.111%,10.30%
考题
某试样除Pb3O4外仅含惰性杂质,称取0.1000g,用盐酸溶解,加热下加入0.02mol·L-1K2Cr2O7标准溶液25.00ml,析出PbCrO4沉淀。冷却后过滤,将沉淀用盐酸溶解后加入淀粉和KI溶液,用0.1000mol·L-1Na2S2O3标准溶液滴定,消耗12.00mL。试样中Pb3O4的质量分数是多少?(Pb3O4分子量685.6)
考题
用减量法从称量瓶中称取0.4000g分析纯的NaOH固体,溶解后稀释到100mL,所得NaOH溶液的浓度为A.小于0.1000mol/LB.等于0.1000mol/LC.大于0.1000mol/LD.以上三种情况都有可能
考题
称取CaCO3试样0.1600 g,加入浓度为0.1025 mol•L^-1的HCl标准溶液20.00 mL。煮沸除去CO2,用浓度为0.1012 mol•L^-1的NaOH标准溶液返滴定过量酸,消耗了10.24 mL NaOH溶液。计算试样中CaCO3的百分含量。
考题
20、制成BaSO4沉淀过程中,正确的操作是()A.称取一定量的试样,加入离子水,搅拌溶解B.称取一定量的试样,加入去离子水和一定浓度的HCl,搅拌溶解C.两份试样可以用同一玻璃棒D.玻璃棒可以从烧杯中取出
热门标签
最新试卷
